Teori Atom Neils Bohr (Model Atom Bohr dan Tingkat Energi Bohr)
Teori atom modern merupakan teori atom yang sudah didasarkan pada percobaan-percobaan, mulai dari teori atom Dalton, Thomson, Rutherford, Bohr, dan mekanika gelombang. teori atom Bohr didasarkan pada spektrum atom hidrogen.
Teori Atom Neils Bohr
Pada tahun 1913, Niels Bohr mengajukan suatu model atom untuk menyempurnakan model atom Rutherford. Penjelasan Bohr didasarkan pada spektrum atom hidrogen yang terdiri atas beberapa garis. Spektrum atom yang berupa garis menandakan bahwa atom tersebut hanya dapat menyerap/memancarkan gelombang elektromagnetik dengan frekuensi tertentu saja.
Bohr menyatakan elektron bergerak di sekitar inti atom dengan lintasan berbentuk lingkaran. Hanya lintasan dengan jari-jari dan energi tertentu saja yang diperbolehkan. Elektron yang bergerak pada lintasan yang diperbolehkan tidak memancarkan energi. Elektron dapat berpindah lintasan dengan menyerap atau memancarkan energi.
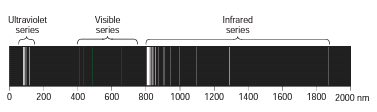
Bohr melakukan serangkaian percobaan atas dasar postulat Planck tentang cahaya dan spektrum hidrogen yang terdiri dari garis-garis. Menurut Planck cahaya merupakan paket energi yang nilainya bergantung pada frekuensi gelombangnya serta hidrogen dapat menyerap dan memancarkan cahaya dengan energi tertentu.
Gambar Spektrum Atom Hidrogen
(Sumber: Silberberg, 2009)
Dari keduanya lahirlah teori atom Bohr yang menyatakan sebagai berikut.
1) Elektron-elektron dalam mengelilingi inti atom berada pada tingkat-tingkat energi atau orbit tertentu. Tingkat-tingkat energi ini dilambangkan dengan n=1, n=2, n=3, dan seterusnya.
2) Tingkat energi elektron yang dibolehkan memiliki momentum sudut tertentu. Besar momentum sudut ini merupakan kelipatan dari h/2p atau nh/2p, “n” adalah bilangan bulat dan “h” tetapan Planck.
Selama elektron berada pada tingkat energi tertentu, misalnya n=1, energi elektron tetap. Artinya, tidak ada energi yang diemisikan (dipancarkan) maupun diserap.
Elektron dapat beralih dari satu tingkat energi ke tingkat energi lain disertai perubahan energi.
Menurut Bohr, elektron berada pada tingkat energi tertentu. Jika elektron turun ke tingkat energi yang lebih rendah, akan disertai emisi cahaya dengan panjang gelombang (λ) tertentu.
Perhatikanlah model atom Bohr dan tingkat energinya pada Gambar !
 |
| (a) Model Atom Bohr |
 |
| (b) Tingkat Energi Bohr |
Gambar (a) Model Atom Bohr, (b) Tingkat Energi Bohr
(Sumber: Tro, 2011:293)
Energi radiasi yang diserap oleh atom menyebabkan elektronnya berpindah dari orbit yang berenergi rendah (n lebih kecil) ke orbit yang berenergi lebih tinggi (n lebih besar). Sebaliknya, energi radiasi dipancarkan bila elektron berpindah dari orbit yang berenergi lebih tinggi ke orbit yang berenergi lebih rendah.
Jumlah energi yang diperlukan untuk memindahkan sebuah elektron dalam atom adalah selisih tingkat energi keadaan awal dan keadaan akhir. Pada keadaan stabil, atom hidrogen memiliki energi terendah, yakni elektron berada pada tingkat energi dasar (n=1). Jika elektron menempati n>1, dinamakan keadaan tereksitasi. Keadaan tereksitasi ini tidak stabil dan terjadi jika atom hidrogen menyerap sejumlah energi.
Atom hidrogen pada keadaan tereksitasi tidak stabil sehingga energi yang diserap akan diemisikan kembali menghasilkan garis-garis spektrum, kemudian elektron akan turun ke tingkat energi yang lebih rendah.
Beberapa kelemahan Model Atom Bohr:
1) Jika atom ditempatkan dalam medan magnet maka akan terbentuk spektrum emisi yang rumit. Gejala ini disebut efek Zeeman.
2) Jika atom ditempatkan dalam medan listrik maka akan menghasilkan spektrum halus yang rumit. Gejala ini disebut efek Strack.
Kegagalan teori atom Bohr dalam menerangkan spektra atom hidrogen dalam medan magnet dan medan listrik, muncullah teori-teori baru tentang atom. Pakar fisika Jerman, Sommerfeld menyarankan, disamping orbit berbentuk lingkaran juga harus mencakup orbit berbentuk elips. Hasilnya, efek Zeeman dapat dijelaskan dengan model tersebut, tetapi model atom Bohr-Sommerfeld tidak mampu menjelaskan spektrum dari atom berelektron banyak.
Modul Pendidikan Profesi Guru, Modul 1. Struktur Atom dan Sistem Periodik, Penulis : Dr. Yerimadesi, S.Pd., M.Si.
Modul Pengembangan Keprofesian Berkelanjutan, Kelompok Kompetensi A : Struktur Atom dan Tabel Periodik, Penulis : Dr. Poppy Kamalia Devi, M.Pd.
Bagikan Artikel

Komentar
Posting Komentar