Hubungan Konfigurasi Elektron dengan Sistem Periodik Unsur
Dalam tabel modern, unsur-unsur terdaftar dalam urutan peningkatan nomor atom daripada peningkatan massa relatif. Tabel periodik modern juga mengandung lebih banyak unsur daripada tabel asli Mendeleev karena banyak lagi yang telah ditemukan sejak zamannya.
Hukum periodik Mendeleev didasarkan pada observasi. Unsur-unsur dalam tabel periodik dapat secara luas diklasifikasikan sebagai logam, bukan logam, dan metaloid. Logam menempati sisi kiri tabel periodik dan memiliki sifat serupa: yaitu konduktor panas dan listrik yang baik; dapat ditumbuk menjadi lembaran datar (kelenturan); bisa ditarik ke dalam kabel (daktilitas); sering mengkilap; dan cenderung kehilangan elektron ketika mengalami perubahan kimia. Contoh logam yang baik adalah besi, magnesium, kromium, dan natrium. Bukan logam menempati sisi kanan tabel periodik (Syukri, 1999, Jespersen, et al., 2012, & Chang, 2011).
Kedudukan dan jumlah elektron dalam masing-masing tingkat disebut konfigurasi elektron. Penulisan konfigurasi elektron harus sesuai dengan aturan Aufbau, larangan Pauli dan aturan Hund. Untuk itu pelajari kembali ketiga aturan penulisan konfigurasi elektron ini pada modul 1, kegiatan belajar 1 (M1KB1) sebelumnya.
Bagaimana caranya menentukan letak suatu unsur dalam sistem periodik? Melalui konfigurasi elektron, Anda dapat menentukan terletak pada golongan dan periode berapa suatu unsur. Salah satunya berdasarkan konfigurasi elektron yang mengikuti aturan Aufbau yaitu cara s, p, d, dan f. Konfigurasi elektron menggambarkan sebaran/susunan elektron dalam suatu atom. Konfigurasi elektron dapat dituliskan berdasarkan nomor atom unsur yang diketahui.
Kemungkinan daerah ditemukannya elektron dalam suatu atom disebut orbital. Tingkat energi orbital atom terdiri dari s, p, d, dan f. Orbital s maksimal diisi oleh 2 elektron, orbital p diisi oleh 6 elektron, orbital d diisi oleh 10 elektron, dan orbital f diisi oleh 14 elektron. Orbital p akan mempunyai tiga arah orbital yaitu px, py, dan pz. orbital d mempunyai 5 arah orbital yaitu dxy, dxz, dyz, dx2 2, dan dz2 yang masing-masing berisi 2 elektron. Sementara itu orbital f mempunyai 7 arah orbital. Amatilah Gambar
 |
| Gambar Orbital ersen, et al., 2012) |
 |
| Gambar Orbital dxy, dxz, dyz, dx2 y2, dan dz2 (Jespersen, et. al., 2012 dan Chang, 2011) |
Dari Gambar dapat dilihat bahwa elektron tidak hanya berada pada suatu orbit, tetapi pada suatu daerah atau ruang dengan arah orbital tertentu. Untuk pengisian elektron dalam suatu atom. Coba perhatikan kembali urutan konfigurasi elektron berdasarkan aturan Aufbau.
Berdasarkan aturan Aufbau, dapat dibuatkan konfigurasi elektron dari suatu atom. Subkulit atom terdiri dari subkulit s, p, d, dan f. Subkulit s maksimal diisi oleh 2 elektron, subkulit p diisi oleh 6 elektron, subkulit d diisi oleh 10 elektron, dan subkulit f diisi oleh 14 elektron (Chang, 2011) .
Coba Anda perhatikan Gambar !
 |
Gambar Konfigurasi Elektron Unsur-unsur pada Keadaan Dasar (Sumber: Chang,2010) |
Golongan IA | Golongan IIA |
Li [He] 2s1 | Be [He] 2s2 |
Na [Ne] 3s1 | Mg [Ne] 3s2 |
K [Ar] 4s1 | Ca [Ar] 4s2 |
Rb [Kr] 5s1 | Sr [Kr] 5s2 |
Cs [Xe] 6s1 | Ba [Xe] 6s2 |
Fr [Rn] 7s1 | Ra [Rn] 7s2 |
(Jespersen, et al., 2012 dan Petrucci, at. al., 2017)
Dari Tabel 1.3 dapat dilihat bahwa semua unsur golongan IA yaitu logam alkali memiliki konfigurasi elektron terluar yang mirip, masing-masing memiliki inti gas mulia dan konfigurasi ns1 untuk elektron terluarnya. Demikian pula golongan IIA yaitu logam alkali tanah juga mempunyai inti gas mulia dan konfigurasi elektron terluar ns2. Elektron terluar suatu atom yang terlibat dalam ikatan kimia disebut elektron valensi (valence electron).
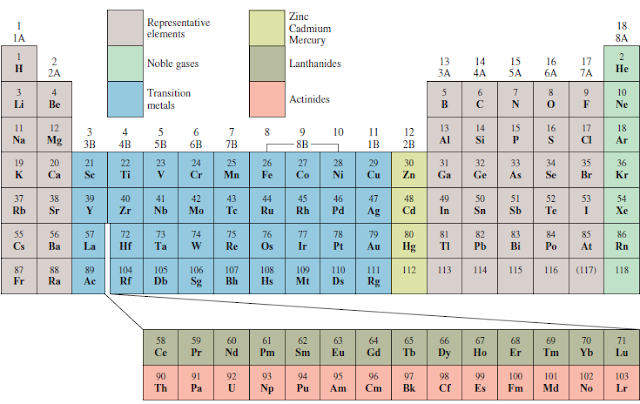
Jumlah elektron valensi yang sama menentukan kemiripan sifat kimia diantara unsur-unsur setiap golongan. Hal ini juga berlaku untuk halogen (unsur-unsur golongan VIIA), yang memiliki konfigurasi elektron terluar ns2np5 dan menunjukkan sifat-sifat yang sangat mirip. Kita harus berhati-hati dalam meramalkan sifat-sifat golongan IIIA sampai VI A. Sebagai contoh, unsur-unsur dalam golongan IVA memiliki konfigurasi elektron terluar yang sama ns2np4, tetapi terdapat lebih banyak keragaman dalam sifat- sifat kimia diantara unsur-unsur berikut ini: karbon adalah non logam, silikon dan germanium adalah metaloid, serta timah dan timbal adalah logam. Penggolongan sifat-sifat unsur dapat dilihat pada Gambar berikut.
Dalam satu golongan, unsur-unsur gas mulia memiliki sifat yang sama, kecuali Kripton dan Xenon karena unsur ini secara kimia bersifat inert. Hal ini disebabkan karena subkulit terluar dari unsur ini terisi penuh (ns2np6) yaitu suatu keadaan yang menggambarkan kestabilan tinggi.
Walaupun konfigurasi elektron terluar logam transisi tidak selalu sama dalam satu golongan dan tidak ada pola yang teratur dalam perubahan konfigurasi elektron dari satu logam ke logam lain dalam periode yang sama, seluruh logam transisi memiliki ciri-ciri tertentu yang membedakannya dari unsur-unsur lainnya. Hal ini karena seluruh logam-logam ini memiliki subkulit d yang tidak terisi penuh. Demikian pula unsur-unsur lantanida dan aktinida menyerupai satu sama lain dalam deretnya karena mempunyai subkulit f yang tidak terisi penuh.
Sumber
Modul Pendidikan Profesi Guru, Modul 1. Struktur Atom dan Sistem Periodik, Penulis : Dr. Yerimadesi, S.Pd., M.Si.
Modul Pengembangan Keprofesian Berkelanjutan, Kelompok Kompetensi A : Struktur Atom dan Tabel Periodik, Penulis : Dr. Poppy Kamalia Devi, M.Pd.
Bagikan Artikel
Komentar
Posting Komentar