Sistem Periodik Unsur
Manusia cenderung mengelompokkan sesuatu dengan kriteria tertentu agar mudah mengingat, mencari atau memakainya. Begitu pula dengan unsur-unsur kimia, setiap unsur memiliki sifat kimia dan sifat fisika yang berbeda. Sejak semula, para ahli kimia telah mengamati bahwa sekelompok unsur tertentu menunjukkan sifat-sifat yang mirip.
Pada abad kesembilan belas kimiawan menemukan pengulangan periodik yang teratur dalam sifat-sifat fisika dan kimia, sehingga ditemukan suatu sistem yang dikenal dengan istilah sistem periodik unsur atau tabel periodik unsur.
a. Perkembangan sistem periodik unsur
Pada abad kesembilan belas, ketika para kimiawan masih samar-samar dalam memahami gagasan tentang atom dan molekul, dan belum mengetahui adanya elektron dan proton, mereka menyusun tabel periodik dengan menggunakan pengetahuannya tentang massa atom.
Mereka telah melakukan pengukuran massa atom dari sejumlah unsur dengan teliti. Penyusunan unsur-unsur menurut massa atomnya dalam tabel periodik tampak logis bagi para kimiawan yang berpendapat bahwa perilaku kimia bagaimanapun juga harus berhubungan dengan massa atom.
1) Sistem Periodik Dobereiner
Johann W Dobereiner, pada tahun 1817 menemukan kelompok tiga unsur yang mempunyai kemiripan sifat yang ada hubungannya dengan massa atom relative. Pada tahun itu, telah dikenal sekitar 40 macam unsur.
2) Sistem Periodik Newlands
Daftar unsur yang disusun oleh Newlands ini dinamakan dengan Hukum Oktaf Newland. (Achmad, 2001 dan Syukri, 1999). John Newlands menyusun unsur dalam kelompok tujuh unsur dan menemukan hubungan antara sifat unsur dengan massa atom relatifnya, yaitu:
“Jika unsur disusun berdasarkan kenaikan massa atom relatifnya, maka pada unsur kedelapan sifatnya mirip dengan unsur yang pertama, dan unsur yang kesembilan dengan unsur yang kedua, dan seterusnya” (Syukri, 1999).
Tabel Penggolongan Unsur Menurut Hukum Oktaf Newlands
|
I |
II |
III |
IV |
V |
VI |
VII |
|
Li 6,94 |
Be 9,01 |
B 10,9 |
C 12 |
N 14 |
O 16 |
F 19 |
|
Na 23 |
Mg 24,3 |
Al 27 |
Si 28,1 |
P 31 |
S 32,1 |
Cl 35,5 |
|
K 39,1 |
Ca 40,1 |
Ti 47,9 |
Cr 52,0 |
Mn 54,9 |
Fe 55,9 |
Dst |
(Achmad, 2001)
3) Sistem Periodik Mendeleev
Dalam waktu tiga tahun setelah Newlands mengumumkan “Hukum Oktaf” Lothar Meyer dan Dimitri Ivanovich Mendeleev bekerja di tempat terpisah menemukan hubungan yang lebih terperinci antara massa atom relatif dan sifat unsur. Tabel menunjukkan bahwa unsur-unsur yang sifatnya mirip, terletak di tempat tertentu dalam setiap bagian tabel yang mirip bentuknya.
Sistem perioduk Mendeleev memiliki beberapa kelebihan, yaitu Sifat kimia dan fisika unsur dalam satu golongan mirip dan berubah secara teratur, Kemiripan sifat ini dikenal sebagai hubungan diagonal, Valensi tertinggi suatu unsur sama dengan nomor golongannya, Dapat meramalkan sifat unsur yang belum ditemukan waktu itu dan telah mempunyai tempat yang kosong, Perubahan sifat yang mendadak dari unsur halogen yang sangat elektronegatif ke unsur alkali yang sangat elektropositif menunjukkan adanya sekelompok unsur yang tidak bersifat elektronegatif maupun elektropositif, dan Daftar ini tidak mengalami perubahan setelah ditemukan unsur-unsur gas mulia He, Ne, Ar, Kr, Xe, Rn diantara tahun 1890-1900.
4) Sistem Periodik Modern
Sistem periodik modern (disebut juga sistem periodik panjang) disusun berdasarkan konfigurasi elektron unsur. Letak unsur dalam sistem ini ditentukan oleh orbital yang terisi paling akhir. Sistem periodik terdiri atas periode (baris/row, horizontal) dan golongan (kolom vertikal).
Dalam sistem periodik, tiap unsur terletak pada kotak tertentu sehingga ada kelompok yang mempunyai kemiripan sifat. Kemiripan itu terdapat dalam arah vertikal, horizontal dan diagonal. (Syukri,1999 & Jespersen, et al., 2012).
Untuk lebih memahami perkembangan unsur, silahkan dilihat, dipelajari dan dipahami video perkembangan sistem periodic lengkap pada link: https://www.youtube.com/watch?v=SpsHNCXgVao
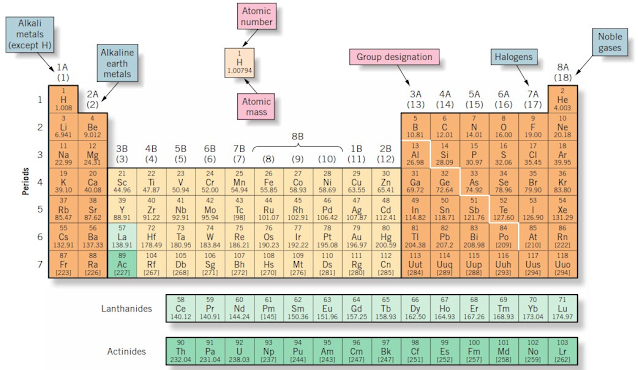 |
| Gambar Tabel Periodik Modern (Jespersen et.al., 2012:73 dan M. E. Wieser) |
b. Penggolongan periodik unsur
Dalam tabel periodik modern, periode dan golongan ditandai dengan angka biasa atau arab. Sistem penomoran yang selama ini dipakai di Amerika Serikat hamper sama dengan sistem Mendeleev, setiap golongan menggunakan angka Romawi dan huruf A atau B. (Brady, at.al., 2009).
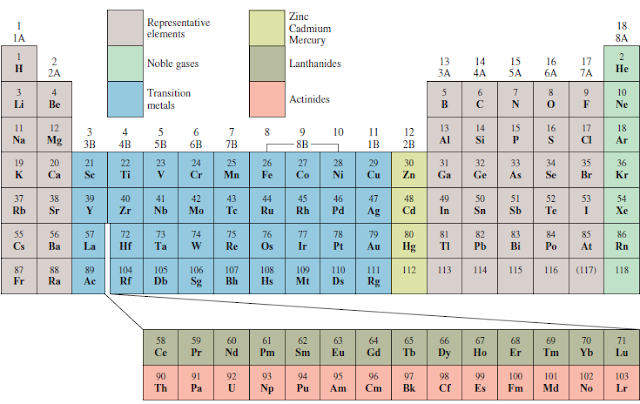
Unsur-unsur di kolom yang lebih panjang (golongan A) dikenal sebagai unsur representatif atau unsur golongan utama. Yang termasuk dalam golongan B di tengah tabel disebut unsur transisi. Unsur dalam dua baris panjang di bawah badan utama tabel adalah unsur transisi bagian dalam, dan setiap baris diberi nama setelah unsur yang mengikuti di bagian utama tabel.
Dengan demikian, unsur 58–71 disebut unsur lantanida karena mereka mengikuti lantanum (Z =57), dan unsur 90-103 disebut unsur aktinida karena mereka mengikuti actinium (Z = 89). Beberapa golongan telah memperoleh nama umum. Misalnya, kecuali untuk hidrogen, unsur-unsur Golongan 1A adalah logam. Mereka membentuk senyawa dengan oksigen yang larut dalam air untuk memberikan solusi yang sangat basa, atau kaustik. Akibatnya, mereka disebut logam alkali atau hanya alkali. Unsur-unsur Golongan 2A juga merupakan logam.
Senyawa oksigennya juga bersifat basa, tetapi banyak senyawa dari unsur Golongan 2A yang tidak dapat larut dalam air dan ditemukan dalam endapan di tanah. Karena sifat mereka dan di mana mereka terjadi di alam, unsur-unsur Golongan 2A dikenal sebagai logam alkali tanah.
Golongan 8A, disebut gas mulia, dulu disebut gas inert sampai diketahui bahwa anggota yang lebih berat dari golongan tersebut menunjukkan tingkat reaktivitas kimia yang kecil. Istilah mulia digunakan ketika ahli ingin menyarankan tingkat reaktivitas kimia yang sangat terbatas. Emas, misalnya, sering disebut sebagai logam mulia karena sangat sedikit bahan kimia yang mampu bereaksi dengannya. Akhirnya, unsur-unsur Golongan 7A disebut halogen, berasal dari kata Yunani yang berarti "laut" atau "garam." Klorin (Cl), misalnya, ditemukan dalam garam meja yang dikenal, suatu senyawa yang bertanggung jawab besar dalam rasa air laut yang asin. Golongan lain dari unsur perwakilan memiliki nama yang jarang digunakan, dan kami akan menamai golongan tersebut berdasarkan unsur pertama dalam keluarga. Misalnya, golongan 5A adalah kelompok nitrogen.
Tabel Nama Beberapa Golongan dalam Tabel Periodik
|
Golongan |
Nama |
Unsur |
|
1A/1 |
Logam Alkali |
Li,Na, K, Rb,Cs, Fr |
|
2A/2 |
Logam Alkali Tanah |
Be, Mg,Ca, Sr, Ba, Ra |
|
6A/16 |
Chalcogens |
O, S, Se, Te, Po |
|
7A/17 |
Halogen |
F, Cl, Br, I, At |
|
8A/18 |
Gas Mulia |
He, Ne,Ar, Kr,Xe, Rn |
(Brown, at. al., 2012; 51)
Untuk lebih memahami materi ini, silahkan lihat dan pahami video penggolongan periodikunsur lengkap pada link https://www.youtube.com/watch?v=C61fAcPXxCU.
c. Hubungan Konfigurasi Elektron dengan Sistem Periodik Unsur
Dalam tabel modern, unsur-unsur terdaftar dalam urutan peningkatan nomor atom daripada peningkatan massa relatif. Tabel periodik modern juga mengandung lebih banyak unsur daripada tabel asli Mendeleev karena banyak lagi yang telah ditemukan sejak zamannya.
Hukum periodik Mendeleev didasarkan pada observasi. Unsur-unsur dalam tabel periodik dapat secara luas diklasifikasikan sebagai logam, bukan logam, dan metaloid. Logam menempati sisi kiri tabel periodik dan memiliki sifat serupa: yaitu konduktor panas dan listrik yang baik; dapat ditumbuk menjadi lembaran datar (kelenturan); bisa ditarik ke dalam kabel (daktilitas); sering mengkilap; dan cenderung kehilangan elektron ketika mengalami perubahan kimia. Contoh logam yang baik adalah besi, magnesium, kromium, dan natrium. Bukan logam menempati sisi kanan tabel periodik (Syukri, 1999, Jespersen, et al., 2012, & Chang, 2011).
Kedudukan dan jumlah elektron dalam masing-masing tingkat disebut konfigurasi elektron. Penulisan konfigurasi elektron harus sesuai dengan aturan Aufbau, larangan Pauli dan aturan Hund. Untuk itu pelajari kembali ketiga aturan penulisan konfigurasi elektron ini pada modul 1, kegiatan belajar 1 (M1KB1) sebelumnya.
Bagaimana caranya menentukan letak suatu unsur dalam sistem periodik? Melalui konfigurasi elektron, Anda dapat menentukan terletak pada golongan dan periode berapa suatu unsur. Salah satunya berdasarkan konfigurasi elektron yang mengikuti aturan Aufbau yaitu cara s, p, d, dan f. Konfigurasi elektron menggambarkan sebaran/susunan elektron dalam suatu atom. Konfigurasi elektron dapat dituliskan berdasarkan nomor atom unsur yang diketahui.
Kemungkinan daerah ditemukannya elektron dalam suatu atom disebut orbital. Tingkat energi orbital atom terdiri dari s, p, d, dan f. Orbital s maksimal diisi oleh 2 elektron, orbital p diisi oleh 6 elektron, orbital d diisi oleh 10 elektron, dan orbital f diisi oleh 14 elektron. Orbital p akan mempunyai tiga arah orbital yaitu px, py, dan pz. orbital d mempunyai 5 arah orbital yaitu dxy, dxz, dyz, dx2 2, dan dz2 yang masing-masing berisi 2 elektron. Sementara itu orbital f mempunyai 7 arah orbital. Amatilah Gambar
 |
| Gambar Orbital ersen, et al., 2012) |
 |
| Gambar Orbital dxy, dxz, dyz, dx2 y2, dan dz2 (Jespersen, et. al., 2012 dan Chang, 2011) |
Dari Gambar dapat dilihat bahwa elektron tidak hanya berada pada suatu orbit, tetapi pada suatu daerah atau ruang dengan arah orbital tertentu. Untuk pengisian elektron dalam suatu atom. Coba perhatikan kembali urutan konfigurasi elektron berdasarkan aturan Aufbau.
Berdasarkan aturan Aufbau, dapat dibuatkan konfigurasi elektron dari suatu atom. Subkulit atom terdiri dari subkulit s, p, d, dan f. Subkulit s maksimal diisi oleh 2 elektron, subkulit p diisi oleh 6 elektron, subkulit d diisi oleh 10 elektron, dan subkulit f diisi oleh 14 elektron (Chang, 2011) .
Coba Anda perhatikan Gambar !
 |
Gambar Konfigurasi Elektron Unsur-unsur pada Keadaan Dasar (Sumber: Chang,2010) |
|
Golongan IA |
Golongan IIA |
|
Li [He] 2s1 |
Be [He] 2s2 |
|
Na [Ne] 3s1 |
Mg [Ne] 3s2 |
|
K [Ar] 4s1 |
Ca [Ar] 4s2 |
|
Rb [Kr] 5s1 |
Sr [Kr] 5s2 |
|
Cs [Xe] 6s1 |
Ba [Xe] 6s2 |
|
Fr [Rn] 7s1 |
Ra [Rn] 7s2 |
(Jespersen, et al., 2012 dan Petrucci, at. al., 2017)
Dari Tabel 1.3 dapat dilihat bahwa semua unsur golongan IA yaitu logam alkali memiliki konfigurasi elektron terluar yang mirip, masing-masing memiliki inti gas mulia dan konfigurasi ns1 untuk elektron terluarnya. Demikian pula golongan IIA yaitu logam alkali tanah juga mempunyai inti gas mulia dan konfigurasi elektron terluar ns2. Elektron terluar suatu atom yang terlibat dalam ikatan kimia disebut elektron valensi (valence electron).
Jumlah elektron valensi yang sama menentukan kemiripan sifat kimia diantara unsur-unsur setiap golongan. Hal ini juga berlaku untuk halogen (unsur-unsur golongan VIIA), yang memiliki konfigurasi elektron terluar ns2np5 dan menunjukkan sifat-sifat yang sangat mirip. Kita harus berhati-hati dalam meramalkan sifat-sifat golongan IIIA sampai VI A. Sebagai contoh, unsur-unsur dalam golongan IVA memiliki konfigurasi elektron terluar yang sama ns2np4, tetapi terdapat lebih banyak keragaman dalam sifat- sifat kimia diantara unsur-unsur berikut ini: karbon adalah non logam, silikon dan germanium adalah metaloid, serta timah dan timbal adalah logam. Penggolongan sifat-sifat unsur dapat dilihat pada Gambar berikut.
Dalam satu golongan, unsur-unsur gas mulia memiliki sifat yang sama, kecuali Kripton dan Xenon karena unsur ini secara kimia bersifat inert. Hal ini disebabkan karena subkulit terluar dari unsur ini terisi penuh (ns2np6) yaitu suatu keadaan yang menggambarkan kestabilan tinggi.
Walaupun konfigurasi elektron terluar logam transisi tidak selalu sama dalam satu golongan dan tidak ada pola yang teratur dalam perubahan konfigurasi elektron dari satu logam ke logam lain dalam periode yang sama, seluruh logam transisi memiliki ciri-ciri tertentu yang membedakannya dari unsur-unsur lainnya. Hal ini karena seluruh logam-logam ini memiliki subkulit d yang tidak terisi penuh. Demikian pula unsur-unsur lantanida dan aktinida menyerupai satu sama lain dalam deretnya karena mempunyai subkulit f yang tidak terisi penuh.
Sumber
Modul Pendidikan Profesi Guru, Modul 1. Struktur Atom dan Sistem Periodik, Penulis : Dr. Yerimadesi, S.Pd., M.Si.
Modul Pengembangan Keprofesian Berkelanjutan, Kelompok Kompetensi A : Struktur Atom dan Tabel Periodik, Penulis : Dr. Poppy Kamalia Devi, M.Pd.
Bagikan Artikel
Komentar
Posting Komentar