Perkembangan sistem periodik unsur
Manusia cenderung mengelompokkan sesuatu dengan kriteria tertentu agar mudah mengingat, mencari atau memakainya. Begitu pula dengan unsur-unsur kimia, setiap unsur memiliki sifat kimia dan sifat fisika yang berbeda. Sejak semula, para ahli kimia telah mengamati bahwa sekelompok unsur tertentu menunjukkan sifat-sifat yang mirip.
Pada abad kesembilan belas kimiawan menemukan pengulangan periodik yang teratur dalam sifat-sifat fisika dan kimia, sehingga ditemukan suatu sistem yang dikenal dengan istilah sistem periodik unsur atau tabel periodik unsur.
Perkembangan sistem periodik unsur
Pada abad kesembilan belas, ketika para kimiawan masih samar-samar dalam memahami gagasan tentang atom dan molekul, dan belum mengetahui adanya elektron dan proton, mereka menyusun tabel periodik dengan menggunakan pengetahuannya tentang massa atom.
Mereka telah melakukan pengukuran massa atom dari sejumlah unsur dengan teliti. Penyusunan unsur-unsur menurut massa atomnya dalam tabel periodik tampak logis bagi para kimiawan yang berpendapat bahwa perilaku kimia bagaimanapun juga harus berhubungan dengan massa atom.
1) Sistem Periodik Dobereiner
Johann W Dobereiner, pada tahun 1817 menemukan kelompok tiga unsur yang mempunyai kemiripan sifat yang ada hubungannya dengan massa atom relative. Pada tahun itu, telah dikenal sekitar 40 macam unsur.
2) Sistem Periodik Newlands
Daftar unsur yang disusun oleh Newlands ini dinamakan dengan Hukum Oktaf Newland. (Achmad, 2001 dan Syukri, 1999). John Newlands menyusun unsur dalam kelompok tujuh unsur dan menemukan hubungan antara sifat unsur dengan massa atom relatifnya, yaitu:
“Jika unsur disusun berdasarkan kenaikan massa atom relatifnya, maka pada unsur kedelapan sifatnya mirip dengan unsur yang pertama, dan unsur yang kesembilan dengan unsur yang kedua, dan seterusnya” (Syukri, 1999).
Tabel Penggolongan Unsur Menurut Hukum Oktaf Newlands
I | II | III | IV | V | VI | VII |
Li 6,94 | Be 9,01 | B 10,9 | C 12 | N 14 | O 16 | F 19 |
Na 23 | Mg 24,3 | Al 27 | Si 28,1 | P 31 | S 32,1 | Cl 35,5 |
K 39,1 | Ca 40,1 | Ti 47,9 | Cr 52,0 | Mn 54,9 | Fe 55,9 | Dst |
(Achmad, 2001)
3) Sistem Periodik Mendeleev
Dalam waktu tiga tahun setelah Newlands mengumumkan “Hukum Oktaf” Lothar Meyer dan Dimitri Ivanovich Mendeleev bekerja di tempat terpisah menemukan hubungan yang lebih terperinci antara massa atom relatif dan sifat unsur. Tabel menunjukkan bahwa unsur-unsur yang sifatnya mirip, terletak di tempat tertentu dalam setiap bagian tabel yang mirip bentuknya.
Sistem perioduk Mendeleev memiliki beberapa kelebihan, yaitu Sifat kimia dan fisika unsur dalam satu golongan mirip dan berubah secara teratur, Kemiripan sifat ini dikenal sebagai hubungan diagonal, Valensi tertinggi suatu unsur sama dengan nomor golongannya, Dapat meramalkan sifat unsur yang belum ditemukan waktu itu dan telah mempunyai tempat yang kosong, Perubahan sifat yang mendadak dari unsur halogen yang sangat elektronegatif ke unsur alkali yang sangat elektropositif menunjukkan adanya sekelompok unsur yang tidak bersifat elektronegatif maupun elektropositif, dan Daftar ini tidak mengalami perubahan setelah ditemukan unsur-unsur gas mulia He, Ne, Ar, Kr, Xe, Rn diantara tahun 1890-1900.
4) Sistem Periodik Modern
Sistem periodik modern (disebut juga sistem periodik panjang) disusun berdasarkan konfigurasi elektron unsur. Letak unsur dalam sistem ini ditentukan oleh orbital yang terisi paling akhir. Sistem periodik terdiri atas periode (baris/row, horizontal) dan golongan (kolom vertikal).
Dalam sistem periodik, tiap unsur terletak pada kotak tertentu sehingga ada kelompok yang mempunyai kemiripan sifat. Kemiripan itu terdapat dalam arah vertikal, horizontal dan diagonal. (Syukri,1999 & Jespersen, et al., 2012).
Untuk lebih memahami perkembangan unsur, silahkan dilihat, dipelajari dan dipahami video perkembangan sistem periodic lengkap pada link: https://www.youtube.com/watch?v=SpsHNCXgVao
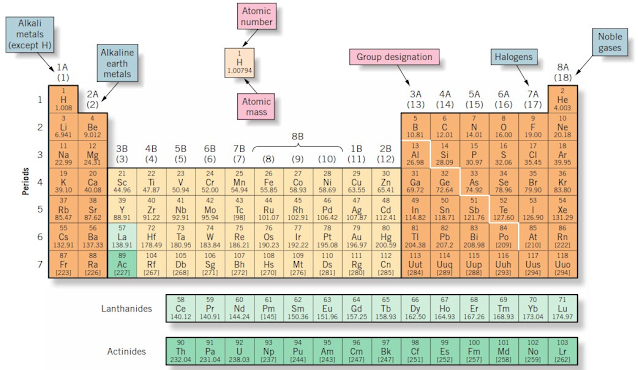 |
| Gambar Tabel Periodik Modern (Jespersen et.al., 2012:73 dan M. E. Wieser) |
Sumber
Modul Pendidikan Profesi Guru, Modul 1. Struktur Atom dan Sistem Periodik, Penulis : Dr. Yerimadesi, S.Pd., M.Si.
Modul Pengembangan Keprofesian Berkelanjutan, Kelompok Kompetensi A : Struktur Atom dan Tabel Periodik, Penulis : Dr. Poppy Kamalia Devi, M.Pd.
Bagikan Artikel
Komentar
Posting Komentar