Teori atom modern merupakan teori atom yang sudah didasarkan pada percobaan-percobaan, mulai dari teori atom Dalton, Thomson, Rutherford, Bohr, dan mekanika gelombang. Teori atom didasarkan pada hukum dasar kimia (Hukum Lavoisier, Proust, dan hukum Dalton sendiri). Namun, Dalton tidak hanya dapat menjelaskan hukum dasar kimia, tetapi juga hukum penyatuan volume dan hukum Avogadro. Teori atom Thomson berdasarkan percobaan tabung sinar katoda, Teori atom Rutherford berdasarkan percobaan penembakkan sinar alfa pada suatu lempeng emas tipis, teori atom Bohr didasarkan pada spektrum atom hidrogen, dan teori atom mekanika gelombang didasarkan pada persamaan Heisenberg, hukum Enstein, dan hukum Planck.
Perkembangan teori atom merupakan dasar dalam mempelajari struktur atom dan sistem periodik unsur. Dengan mengetahui perkembangan teori atom, kita bisa mengetahui partikel-partikel penyusun suatu atom. Pemahaman hukum dasar kimia akan memudahkan kita dalam mempelajari materi stoikiometri, dan materi kimia lainnya.
Perkembangan teori Atom
Filsuf Yunani Democritus (470 – 400 SM) mengungkapkan keyakinannya bahwa semua materi terdiri atas partikel yang sangat kecil dan tidak dapat dibagi lagi, yang ia namakan atomos (berarti tidak dapat dibelah/dibagi). Walaupun gagasan Democritus ini tidak dapat diterima oleh rekan-rekannya, tetapi gagasan ini tetap bertahan. Baru pada tahun 1808, seorang ilmuwan Inggris bernama John Dalton memperoleh bukti percobaan dari penyelidikan ilmiah yang mendukung konsep “atomisme”.
a. Teori Atom Dalton
Pada tahun 1808, John Dalton, seorang ahli kimia di Inggris mengemukakan teori atom. Hipotesis tentang sifat materi yang merupakan landasan teori atom Dalton dapat dirangkumkan sebagai berikut:
1) Unsur tersusun atas partikel yang sangat kecil, yang disebut atom. Semua atom unsur tertentu adalah identik, yaitu mempunyai ukuran, massa, dan sifat kimia yang sama. Atom satu unsur tertentu berbeda dari atom semua unsur yang lain.
2) Senyawa tersusun atas atom-atom dari dua unsur atau lebih. Dalam setiap senyawa, perbandingan antara jumlah atom dari setiap dua unsur yang ada bisa merupakan bilangan bulat atau pecahan sederhana.
3) Yang terjadi dalam reaksi kimia hanyalah pemisahan, penggabungan, atau penyusunan ulang atom - atom; reaksi kimia tidak mengakibatkan penciptaan atau pemusnahan atom – atom.
Pada akhir abad ke 19 berdasarkan penemuan fisika mengenai listrik, memberikan bukti-bukti bahwa di dalam atom terdapat subatom atau partikel dasar yang terdiri atas elektron, proton, dan neutron. Atom suatu unsur berbeda dengan atom unsur lain disebabkan oleh perbedaan susunan jumlah partikel subatom penyusun atom tersebut.
Atom demikian kecilnya sehingga tidak dapat dilihat walaupun dengan mikroskop. Akan tetapi, sifat atom dapat dipelajari dari gejala yang timbul bila diberi medan listrik, medan magnet, atau cahaya. Dari gejala-gejala tersebut telah dibuktikan bahwa atom mengandung elektron, proton, dan neutron yang disebut partikel dasar penyusun atom. Dengan ditemukan partikel-partikel atom tersebut, maka munculah konsep struktur atom.
Kelemahan teori atom Dalton, yaitu: tidak dapat menjelaskan adanya partikel yang lebih kecil dari atom yang disebut partikel subatom; dan tidak dapat menerangkan sifat listrik atom. Dalton menggambarkan model atom seperti Gambar .
 |
Gambar Model Atom Dalton Sumber : Silberberg, 2009; Chang, 2011; Tro, 2011; Jespersen et al., 2012 |
Teori tentang atom terus berkembang sehingga dikenal model-model atom yaitu: model atom Thomson, model atom Rutherford, model atom Bohr dan model atom mekanika gelombang.
b. Teori Atom Thomson
Model atom Thomson berdasarkan kepada percobaan tabung sinar katoda (perhatikan Gambar). Tabung itu berupa tabung kaca yang sebagian besar udaranya sudah disedot keluar. Ketika dua lempeng logam dihubungkan dengan sumber tegangan tinggi, lempeng yang bermuatan negatif, disebut katoda, memancarkan sinar yang tidak terlihat. Sinar katoda ini tertarik ke lempeng bermuatan positif, yang disebut anoda. Sinar itu akan melalui suatu lubang dan terus merambat menuju ujung tabung yang satunya. Ketika sinar ini menumbuk permukaan yang telah dilapisi secara khusus, sinar katoda tersebut menghasilkan pendaran yang kuat, atau cahaya yang terang (Syukri, 1999; Silberberg, 2009; Chang, 2011; Tro, 2011; Jespersen et al., 2012)
 |
Gambar Tabung Sinar Katoda
|
(Sumber: Chang, 2011).
Berdasarkan percobaan sinar katoda, Joseph John Thomson (1897) menyatakan teori atomnya bahwa dalam atom terdapat elektron yang tersebar secara merata dalam bola pejal bermuatan positif.
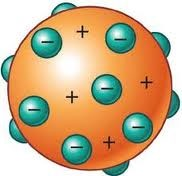 |
| Gambar Model Atom Thomson |
(Sumber: www.ilmukimia.org)
Kelemahan yang dimiliki teori atom Thomson yaitu tidak dapat menjelaskan susunan muatan positif dan negatif dalam atom tersebut. Untuk mengatasi kelemahan tersebut berkembanglah teori atom Rutherford.
c. Teori Atom Ernest Rutherford
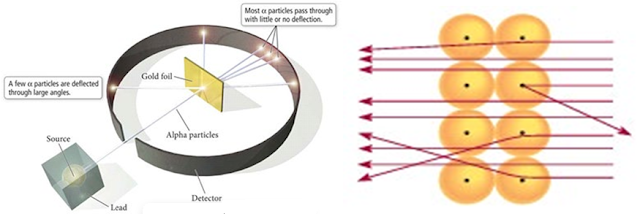
Berdasarkan hasil eksperimen Rutherford tentang penghamburan sinar alfa, membuktikan, bahwa massa suatu atom tertumpu pada inti atom yang bermuatan positif. Rutherford menyarankan suatu model atom yang terdiri atas inti (yang terdiri dari proton yang bermuatan positif dan netron yang tidak bermuatan), serta elektron mengelilingi inti.
Gambar (a) Percobaan Lempeng emas Rutherford dan (b) Pemandangan yang Diperbesar dari Partikel α yang Menembus dan Dibelokkan oleh Inti (Sumber: Chang, 2011)
Kelemahan dari teori atom Rutherford adalah tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom akibat gaya tarik elektrostatis inti terhadap elektron. Teori Rutherford disempurnakan oleh Neils Bohr.
Gambar Model Atom Rutherford
(Sumber: http://chemistry.tutorcircle.com)
d. Teori Atom Neils Bohr
Pada tahun 1913, Niels Bohr mengajukan suatu model atom untuk menyempurnakan model atom Rutherford. Penjelasan Bohr didasarkan pada spektrum atom hidrogen yang terdiri atas beberapa garis. Spektrum atom yang berupa garis menandakan bahwa atom tersebut hanya dapat menyerap/memancarkan gelombang elektromagnetik dengan frekuensi tertentu saja.
Bohr menyatakan elektron bergerak di sekitar inti atom dengan lintasan berbentuk lingkaran. Hanya lintasan dengan jari-jari dan energi tertentu saja yang diperbolehkan. Elektron yang bergerak pada lintasan yang diperbolehkan tidak memancarkan energi. Elektron dapat berpindah lintasan dengan menyerap atau memancarkan energi.
Bohr melakukan serangkaian percobaan atas dasar postulat Planck tentang cahaya dan spektrum hidrogen yang terdiri dari garis-garis. Menurut Planck cahaya merupakan paket energi yang nilainya bergantung pada frekuensi gelombangnya serta hidrogen dapat menyerap dan memancarkan cahaya dengan energi tertentu.

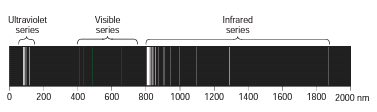
Gambar Spektrum Atom Hidrogen
(Sumber: Silberberg, 2009)
Dari keduanya lahirlah teori atom Bohr yang menyatakan sebagai berikut.
1) Elektron-elektron dalam mengelilingi inti atom berada pada tingkat-tingkat energi atau orbit tertentu. Tingkat-tingkat energi ini dilambangkan dengan n=1, n=2, n=3, dan seterusnya.
2) Tingkat energi elektron yang dibolehkan memiliki momentum sudut tertentu. Besar momentum sudut ini merupakan kelipatan dari h/2p atau nh/2p, “n” adalah bilangan bulat dan “h” tetapan Planck.
Selama elektron berada pada tingkat energi tertentu, misalnya n=1, energi elektron tetap. Artinya, tidak ada energi yang diemisikan (dipancarkan) maupun diserap.
Elektron dapat beralih dari satu tingkat energi ke tingkat energi lain disertai perubahan energi.
Menurut Bohr, elektron berada pada tingkat energi tertentu. Jika elektron turun ke tingkat energi yang lebih rendah, akan disertai emisi cahaya dengan panjang gelombang (λ) tertentu.
Perhatikanlah model atom Bohr dan tingkat energinya pada Gambar !
 |
| (a) Model Atom Bohr |
 |
| (b) Tingkat Energi Bohr |
Gambar (a) Model Atom Bohr, (b) Tingkat Energi Bohr
(Sumber: Tro, 2011:293)
Energi radiasi yang diserap oleh atom menyebabkan elektronnya berpindah dari orbit yang berenergi rendah (n lebih kecil) ke orbit yang berenergi lebih tinggi (n lebih besar). Sebaliknya, energi radiasi dipancarkan bila elektron berpindah dari orbit yang berenergi lebih tinggi ke orbit yang berenergi lebih rendah.
Jumlah energi yang diperlukan untuk memindahkan sebuah elektron dalam atom adalah selisih tingkat energi keadaan awal dan keadaan akhir. Pada keadaan stabil, atom hidrogen memiliki energi terendah, yakni elektron berada pada tingkat energi dasar (n=1). Jika elektron menempati n>1, dinamakan keadaan tereksitasi. Keadaan tereksitasi ini tidak stabil dan terjadi jika atom hidrogen menyerap sejumlah energi.
Atom hidrogen pada keadaan tereksitasi tidak stabil sehingga energi yang diserap akan diemisikan kembali menghasilkan garis-garis spektrum, kemudian elektron akan turun ke tingkat energi yang lebih rendah.
Beberapa kelemahan Model Atom Bohr:
1) Jika atom ditempatkan dalam medan magnet maka akan terbentuk spektrum emisi yang rumit. Gejala ini disebut efek Zeeman.
2) Jika atom ditempatkan dalam medan listrik maka akan menghasilkan spektrum halus yang rumit. Gejala ini disebut efek Strack.
Kegagalan teori atom Bohr dalam menerangkan spektra atom hidrogen dalam medan magnet dan medan listrik, muncullah teori-teori baru tentang atom. Pakar fisika Jerman, Sommerfeld menyarankan, disamping orbit berbentuk lingkaran juga harus mencakup orbit berbentuk elips. Hasilnya, efek Zeeman dapat dijelaskan dengan model tersebut, tetapi model atom Bohr-Sommerfeld tidak mampu menjelaskan spektrum dari atom berelektron banyak.
e. Model Atom Mekanika Gelombang
Pada tahun 1923, muncul gagasan de Broglie tentang dualisme materi dan gelombang, Louis de Broglie mengemukakan bahwa semua materi memiliki sifat gelombang dan setiap partikel yang bergerak memiliki sifat gelombang dengan panjang gelombang tertentu. Elektron yang bergerak mengelilingi inti, keberadaan dalam lintasannya tidak pasti. Hal ini tidak sesuai dengan yang dikemukakan Bohr yaitu elektron bergerak pada lintasan tertentu.
Pada tahun 1926 Erwin Schrodinger dan Werner Heisenberg mengemukakan teori bahwa lokasi elektron dalam atom tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah daerah kemungkinan keberadaan elektron. Oleh karena keberadaan elektron diperkirakan dengan mekanika kuantum maka teori ini disebut teori atom mekanika kuantum.
Menurut teori atom mekanika kuantum, posisi elektron dalam mengelilingi inti atom tidak dapat diketahui secara pasti sesuai prinsip ketidakpastian Heisenberg. Oleh karena itu, kebolehjadian (peluang) terbesar ditemukannya elektron berada pada orbit atom tersebut. Dengan kata lain, orbital adalah daerah kebolehjadian ditemukannya elektron dalam atom.
Menurut model atom mekanika kuantum, gerakan elektron dalam mengelilingi inti atom memiliki sifat dualisme sebagaimana diajukan oleh de Broglie. Oleh karena gerakan elektron dalam mengelilingi inti memiliki sifat seperti gelombang maka persamaan gerak elektron dalam mengelilingi inti harus terkait dengan fungsi
gelombang. Persamaan yang menyatakan gerakan elektron dalam mengelilingi inti atom dihubungkan dengan sifat dualisme materi yang diungkapkan dalam bentuk koordinat Cartesius. Persamaan ini dikenal sebagai persamaan Schrodinger. Dari persamaan Schrodinger ini dihasilkan tiga bilangan kuantum, yaitu bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (m). Orbital diturunkan dari persamaan Schrodinger sehingga terdapat hubungan antara orbital dan ketiga bilangan kuantum tersebut. Gambaran perkembangan model/ teori atom , perhatikan gambar di bawah ini

Gambar Perkembangan Model Atom
(Sumber : mathinssciences.blogspot.com)
Modul Pendidikan Profesi Guru, Modul 1. Struktur Atom dan Sistem Periodik, Penulis : Dr. Yerimadesi, S.Pd., M.Si.
Modul Pengembangan Keprofesian Berkelanjutan, Kelompok Kompetensi A : Struktur Atom dan Tabel Periodik, Penulis : Dr. Poppy Kamalia Devi, M.Pd.
Baca Juga









Komentar
Posting Komentar